我院王亚洲教授课题组基于中性粒细胞外泌体(Exosomes)的纳米效应,及其具有的来源细胞(中性粒细胞)炎症趋化生物学特性。构建了响应胶质瘤炎症微环境的中性粒细胞外泌体载药系统,提高了透血脑屏障(Blood-brain barrier,BBB)药物递送与肿瘤靶向杀伤效率,为中枢神经系统非侵入式靶向药物递送提供了新的策略。该研究进展发表在生物材料领域TOP期刊Biomaterials(IF:10.317)上,重庆大学医学院是本文第一单位和通讯单位。
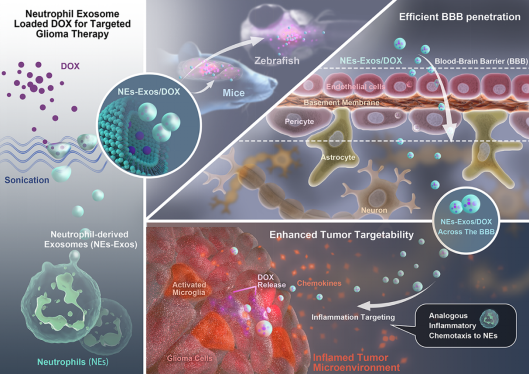
示意图:载阿霉素的中性粒细胞外泌体跨越
胶质瘤(Glioblastoma;GBM)是位于中枢神经系统(Central Nervous System, CNS)的一类恶性程度高、复发率高、致死率高的恶性肿瘤。近几十年来,尽管在肿瘤治疗方面已经取得了相当大的进展,但由于胶质瘤位置特殊、血脑屏障保护、极高的治疗耐受和抵抗,使得病患预后并未有明显改善,其中位生存期仅12个月,而5年生存率更处于所有恶性肿瘤中最低水平。为此,寻求新的胶质瘤治疗策略具有重大意义,特别是如何构建合理的给药策略以克服BBB生理屏障靶向GBM是实现GBM有效治疗的迫切需求。
高度异质性的肿瘤细胞及浸润的间质细胞、免疫细胞,和细胞外成分等共同构成独特肿瘤微环境,其对肿瘤增殖、侵袭转移和免疫逃逸等恶性生物学行为有着极其重要的作用。其中,炎症特性是肿瘤微环境的重要特征之一,而基于响应炎症趋向生物学特性靶向肿瘤微环境药物递送引起了广泛的关注,例如,中性粒细胞作为药物载体的靶向胶质瘤药物递送。但是,直接利用免疫细胞作为药物递送载体,由于化疗药物对载体细胞具有一定毒性,且免疫细胞在肿瘤微环境中扮演着多重的角色,这使得直接用免疫细胞作为药物载体面临一定的挑战性。
外泌体作为细胞外囊泡的一种,由于其具备纳米效应、生物相容性、来源细胞生物学特性以及天然透过生理屏障效应,已经成为药物递送研究领域极具吸引力的新型载体。在本研究中,我们利用中性粒细胞的趋炎特性构建了响应炎症微环境的中性粒细胞外泌体药物递送系统(Neutrophil-Exosomes, NEs-Exos)(如Figure.1所示)。
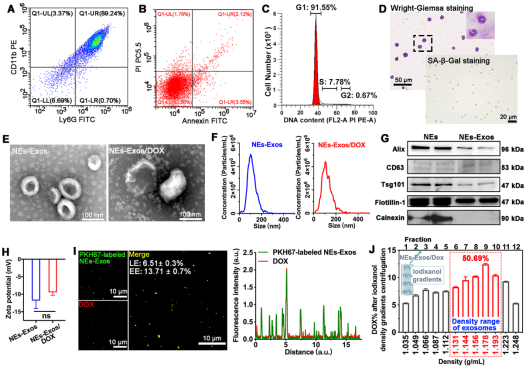
Figure 1. Characterization of NEs and NEs-Exos.
如Figure 2所示,LPS炎症诱导能显著增强C6与bEND3细胞对NEs-Exos的吞噬,与游离阿霉素(DOX)和红细胞外泌体对照,Transwell小室迁移模型的激光共聚焦影像和下室DOX定量分析都证明了NEs-Exos能够响应炎症趋化因子fMLP,具有与来源细胞中性粒细胞相似的炎症趋化特性。
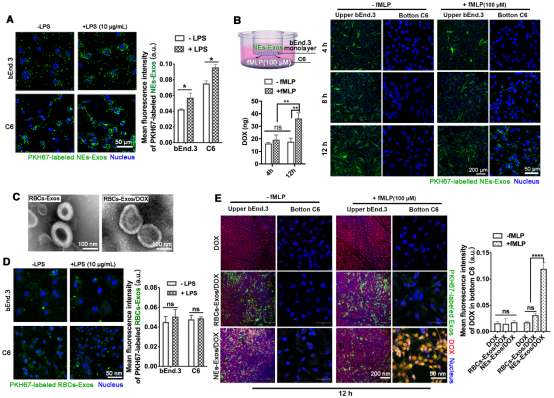
Figure 2. Chemotactic migration and cellular uptake of NEs-Exos under inflammation condition.
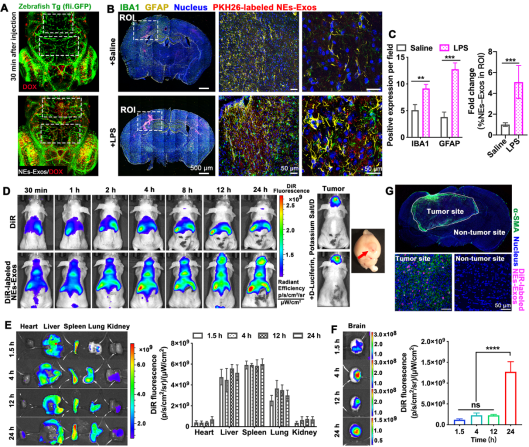
Figure 4. BBB penetration and targeting of NEs-Exos to glioma.
通过斑马鱼模型(转基因斑马鱼,绿色荧光蛋白标记血管)透BBB评价可知,NEs-Exos/DOX(红色荧光)能够成功穿透BBB到达脑实质(Figure 3. A)。NEs-Exos(PKH67标记)静脉注射LPS诱导颅内炎症模型小鼠,相较于生理盐水对照组和非炎症区域,脑切片免疫荧光结果(Figure 3.B)证实NEs-Exos显著聚集于炎症区域(IBA1高表达),而Figure 3.G的结果也进一步指出NEs-Exos聚集区域与肿瘤组织区域高度一致。这些结果充分表明NEs-Exos能够趋向肿瘤组织的炎症微环境。与游离DiR相比(图Figure 3.D-F),NEs-Exos/DiR能够突破BBB生理屏障,携带DiR入脑。胶质瘤原位移植模型药效学实验评价结果表明,NEs-Exos/DOX相较于对照组和游离DOX组,使得胶质瘤快速生长受到抑制,同时,其荷瘤鼠Kaplan-Meier生存曲线显示较之其他组生存期显著延长,体重变化监测提示生存质量得以明显改善。不仅如此Ki67、GFAP和IL-33免疫组化结果也进一步揭示肿瘤的恶性程度显著降低。本文充分证明了NEs-Exos/DOX具有炎症响应特性,能跨越BBB生理屏障靶向聚集于肿瘤炎症微环境,提高抗胶质瘤效应。该研究不仅有助于为胶质瘤提供新的给药策略,也能为其他中枢神经系统疾病的非侵入性炎症微环境靶向药物递送提供新的选择。
论文第一作者为重庆大学硕士生王君,通讯作者为重庆大学医学院王亚洲教授;中国科学院深圳先进技术研究院唐为副研究员是论文的共同第一作者和共同通讯作者。该研究得到了重庆市科技计划项目基础科学与前沿技术研究专项(No.cstc2019jcyj-msxmX0307、cstc2019jcyj-zdxmX0009)国家自然科学基金项目(No. 32071346、31700835),中央高校业务经费(No.2019CDXYSG0004 and 2019CDYGZD002)的支持。
原文信息:Jun Wang, Wei Tang*, Meng Yang, Ying Yin, Hui Li, Fangfang Hu, Lin Tang, Xiaoyue Ma, Yu Zhang, Yazhou Wang*, Inflammatory tumor microenvironment responsive neutrophil exosomes-based drug delivery system for targeted glioma therapy, Biomaterials, 2021, 273: 120784.
https://doi.org/10.1016/j.biomaterials.2021.120784.


